2025年9月10日,馬克和詹妮弗·利普舒爾茨精密免疫學(xué)研究所Miriam Merad團(tuán)隊(duì),在國(guó)際期刊Nature(IF:69.504)發(fā)表了題為“Myeloid progenitor dysregulation fuels immunosuppressive macrophages in tumours"的研究性論文。研究發(fā)現(xiàn)腫瘤不僅會(huì)在腫瘤微環(huán)境(tumour microenvironment, TME)里“馴化"單核細(xì)胞和巨噬細(xì)胞,還會(huì)遠(yuǎn)程操控源頭骨髓(bone marrow)里的髓系祖細(xì)胞(myeloid progenitors),讓它們?cè)谠搭^就帶著免疫抑制屬性。操控開(kāi)關(guān):NRF2((Nuclear factor erythroid 2-related factor 2, 由Nfe2l2基因編碼),NRF2在正常情況下是細(xì)胞的“防身符",主打抗氧化、抗凋亡等。但在腫瘤背景下,NRF2卻被利用,成了驅(qū)動(dòng)髓系祖細(xì)胞分化成超級(jí)免疫抑制型巨噬細(xì)胞(比如 TREM2hi、ARG1hi亞群)。揭示了肺癌通過(guò)遠(yuǎn)程操控骨髓造血,維持免疫抑制的新發(fā)現(xiàn)。肺癌腫瘤會(huì)在免疫細(xì)胞到達(dá)之前就已經(jīng)對(duì)骨髓中的免疫細(xì)胞進(jìn)行了“重新編程",這一發(fā)現(xiàn)為增強(qiáng)當(dāng)前免疫療法的持久性提供了新的靶點(diǎn)。

骨髓是造血系統(tǒng)的核心和源頭,源源不斷地產(chǎn)生著包括免疫細(xì)胞在內(nèi)的各類(lèi)血細(xì)胞。其中,髓系祖細(xì)胞(myeloid progenitors)是巨噬細(xì)胞(macrophages)、單核細(xì)胞(monocytes)等關(guān)鍵免疫細(xì)胞的“前體"。在正常情況下,這個(gè)源頭運(yùn)作井然有序,按需生產(chǎn)。但當(dāng)身體內(nèi)出現(xiàn)腫瘤時(shí),情況就發(fā)生了變化。研究人員首先利用了一個(gè)模擬人類(lèi)非小細(xì)胞肺癌(non-small-cell lung cancer, NSCLC)的小鼠模型(KP模型)。他們觀察到,隨著小鼠體內(nèi)腫瘤的生長(zhǎng),其骨髓的髓系造血功能(myelopoiesis)被異常激活了。具體來(lái)說(shuō),在腫瘤生長(zhǎng)的晚期(例如第21天),骨髓中的關(guān)鍵祖細(xì)胞,如共同髓系祖細(xì)胞(common myeloid progenitors, CMP)、粒細(xì)胞-單核細(xì)胞祖細(xì)胞(granulocytic-monocytic progenitors, GMP)以及單核細(xì)胞定向祖細(xì)胞(committed monocyte progenitor, cMoP)的數(shù)量都顯著增加。這就終端的腫瘤和源頭的髓系祖細(xì)胞產(chǎn)生了通信和共頻。
研究團(tuán)隊(duì)發(fā)現(xiàn),腫瘤誘導(dǎo)骨髓髓系祖細(xì)胞中轉(zhuǎn)錄因子NRF2(由Nfe2l2基因編碼)活性顯著增強(qiáng)。NRF2是細(xì)胞氧化應(yīng)激反應(yīng)的主要調(diào)控因子,其激活本是細(xì)胞對(duì)抗氧化損傷的保護(hù)機(jī)制,但腫瘤卻巧妙地利用這一途徑。研究表明,腫瘤通過(guò)分泌GM-CSF、G-CSF和IL-6等因子,激活骨髓祖細(xì)胞中的NRF2信號(hào)通路。這種激活不僅促進(jìn)了髓系細(xì)胞的增殖和分化,還抑制干擾素信號(hào)通路,降低細(xì)胞的免疫應(yīng)答能力
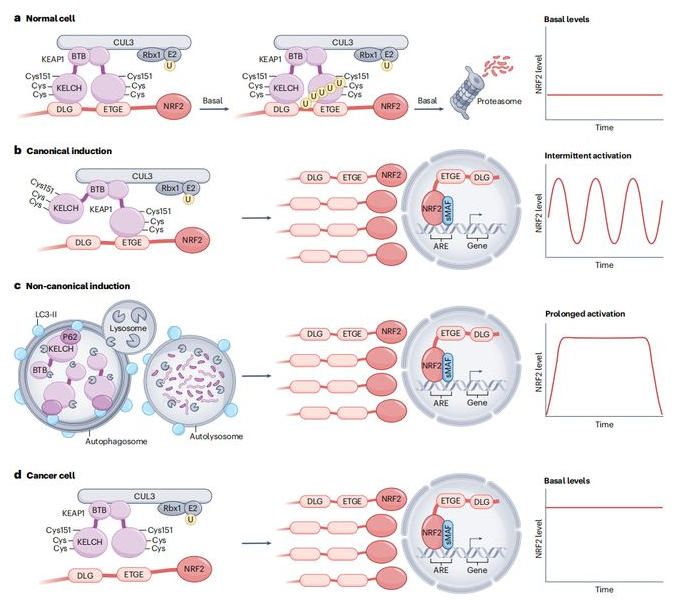
NRF2:氧化應(yīng)激反應(yīng)的關(guān)鍵調(diào)控因子
進(jìn)一步研究發(fā)現(xiàn),這種表觀遺傳重編程在髓系祖細(xì)胞細(xì)胞從骨髓遷移到腫瘤微環(huán)境過(guò)程中持續(xù)存在并被進(jìn)一步強(qiáng)化。研究人員通過(guò)細(xì)胞追蹤實(shí)驗(yàn)發(fā)現(xiàn),那些在骨髓中經(jīng)腫瘤"馴化"的髓系祖細(xì)胞,其后代細(xì)胞在腫瘤微環(huán)境中表現(xiàn)出更強(qiáng)免疫抑制功能。這些細(xì)胞高表達(dá)PD-L1、ARG1等免疫抑制分子,同時(shí)低表達(dá)MHCII、CD86等免疫激活分子,從而有效抑制 T 細(xì)胞和NK細(xì)胞的抗腫瘤活性。應(yīng)用上,通過(guò)遺傳或藥理手段抑制NRF2活性,可顯著降低腫瘤相關(guān)巨噬細(xì)胞的免疫抑制功能。在動(dòng)物模型中,特異性敲除髓系細(xì)胞中的Nfe2l2基因,或者使用NRF2抑制劑(如Brusatol或ML385),都能夠減少免疫抑制性巨噬細(xì)胞的數(shù)量;增加免疫刺激性巨噬細(xì)胞比例;促進(jìn)NK細(xì)胞和T細(xì)胞浸潤(rùn)腫瘤;顯著抑制腫瘤生長(zhǎng)。更重要的是,NRF2抑制劑與抗PD-1免疫檢查點(diǎn)抑制劑聯(lián)合使用表現(xiàn)出協(xié)同增強(qiáng)效應(yīng),顯著提高治療效果。這為解決當(dāng)前免疫治療耐藥性問(wèn)題提供新思路。研究人員還在人類(lèi)肺癌樣本中驗(yàn)證這一機(jī)制。通過(guò)對(duì)患者血液和腫瘤樣本分析,他們發(fā)現(xiàn)NRF2信號(hào)通路在人類(lèi)肺癌相關(guān)髓系細(xì)胞中同樣被激活,且與免疫抑制表型密切相關(guān)。這一發(fā)現(xiàn)具有重要臨床意義。
這項(xiàng)研究的意義遠(yuǎn)遠(yuǎn)超出了發(fā)現(xiàn)一個(gè)新靶點(diǎn)。它更深遠(yuǎn)地改變了我們對(duì)癌癥與免疫系統(tǒng)相互作用的認(rèn)知。過(guò)去,我們傾向于將腫瘤微環(huán)境視為一個(gè)相對(duì)孤立的,終末的“局部戰(zhàn)場(chǎng)"。而這項(xiàng)研究則清晰地告訴我們,這場(chǎng)戰(zhàn)爭(zhēng)從一開(kāi)始就是一場(chǎng)波及全身的“系統(tǒng)性沖突"。這項(xiàng)研究不僅揭示腫瘤免疫編輯的新機(jī)制,更重要的是提出靶向腫瘤系統(tǒng)性影響的治療新策略。傳統(tǒng)的免疫治療主要關(guān)注腫瘤局部微環(huán)境,而這項(xiàng)研究告訴我們需要把目光放得更遠(yuǎn)——骨髓。未來(lái)研究可以探索:針對(duì)NRF2通路的新型小分子抑制劑;聯(lián)合靶向骨髓和腫瘤微環(huán)境的治療策略;基于NRF2活性的患者分層和療效預(yù)測(cè)標(biāo)志物。
荷蘭Liposoma的巨噬細(xì)胞清除劑氯膦酸二鈉脂質(zhì)體Clodronate Liposomes,氯膦酸鹽脂質(zhì)體,廣泛用于體內(nèi)單核巨噬細(xì)胞清除。頻頻登刊Cell,Nature和Science。如需訂購(gòu),可以隨時(shí)聯(lián)系。技術(shù)支持可以聯(lián)系大中華代理商靶點(diǎn)科技(Target Technology),專(zhuān)業(yè)技術(shù)團(tuán)隊(duì)給您單核巨噬細(xì)胞清除提供整套解決方案。
原始文獻(xiàn)
Hegde, S., Giotti, B., Soong, B.Y. et al. Myeloid progenitor dysregulation fuels immunosuppressive macrophages in tumours. Nature 646, 1214–1222 (2025). doi.org/10.1038/s41586-025-09493-y

靶點(diǎn)科技(北京)有限公司
地址:中關(guān)村生命科學(xué)園北清創(chuàng)意園2-4樓2層
© 2025 版權(quán)所有:靶點(diǎn)科技(北京)有限公司 備案號(hào):京ICP備18027329號(hào)-2 總訪(fǎng)問(wèn)量:371136 站點(diǎn)地圖 技術(shù)支持:化工儀器網(wǎng) 管理登陸