2025年12月11日,魏茨曼科學研究所Ido Amit,在國際期刊Cell(IF:45.5)發(fā)表了題為“Macrophage-targeted mmunocytokine leverages myeloid, T, and NK cell synergy for cancer immunotherapy"的研究性論文。該研究開發(fā)了一類名為“髓系靶向免疫細胞因子與NK/T細胞增強劑(Myeloid-targeted immunocytokinesand natural killer (NK)/T cell enhancers,MiTEs)"的新型條件性激活免疫細胞因子,通過同時拮抗腫瘤相關巨噬細胞(TAMs)上的關鍵檢查點TREM2,并在腫瘤局部特異性釋放IL-2超級激動劑,實現(xiàn)了對髓系和淋巴細胞的高效協(xié)同重編程。同時表明,MiTEs在多種臨床前腫瘤模型中展現(xiàn)出好的療效和安全性,并能與PD-1或CTLA-4抗體協(xié)同增效,為克服以免疫檢查點抑制劑(ICI)耐藥性提供了新的治療策略和思路。

髓系細胞上表達的觸發(fā)受體2(Triggering receptor expressed on myeloid cells 2:TREM2)是一種免疫球蛋白超家族的細胞表面受體。TREM2存在于各種組織巨噬細胞中,例如中樞神經系統(tǒng)小膠質細胞、骨破骨細胞、肺泡巨噬細胞、腹膜巨噬細胞和腸道巨噬細胞。TREM2也存在于培養(yǎng)的骨髓來源巨噬細胞和單核細胞來源的樹突狀細胞上。一些研究已經發(fā)現(xiàn)TREM2的一個罕見變異是阿爾茨海默病(AD)的風險因素,AD是常見的晚發(fā)性癡呆形式。TREM2的胞外區(qū)含有單一的免疫球蛋白超家族結構域,并能結合多陰離子配體,如細菌脂多糖(LPS)和磷脂。當配體結合時,TREM2通過一個適配蛋白DAP12(也稱為TYRO蛋白酪氨酸激酶結合蛋白,TYROBP)傳遞細胞內信號,該適配蛋白與TREM2的跨膜區(qū)域相關聯(lián),并通過其胞質內免疫受體酪氨酸基活化基序(ITAMs)招募酪氨酸激酶SYK。TREM2是小鼠模型和人類腫瘤中腫瘤浸潤巨噬細胞的一種促腫瘤標志物,針對TREM2可以抑制腫瘤生長,提高檢查點阻斷治療的療效,同時重塑腫瘤浸潤巨噬細胞的環(huán)境。
免疫檢查點抑制劑(ICIs)和嵌合抗原受體T(CAR-T)細胞療法為代表的癌癥免疫療法在臨床治療中取得了突破性進展。但是,腫瘤微環(huán)境(TME)中的免疫抑制性細胞,尤其是腫瘤相關巨噬細胞(tumor associated macrophages :TAMs),是導致許多患者治療無效或復發(fā)的主要原因之一。TAMs通過多種機制抑制T細胞和NK細胞的活性,促進腫瘤免疫逃逸。雖然靶向TAMs的單一療法在臨床試驗中顯示出良好的安全性,但其療效有限,亟需能夠同時調控髓系和淋巴細胞的新型協(xié)同治療策略。髓系細胞上表達的觸發(fā)受體2(TREM2)的腫瘤相關巨噬細胞(TAMs)是腫瘤微環(huán)境(tumor microenvironment, TME)中關鍵的免疫抑制細胞,驅動腫瘤進展,導致癌癥患者預后不良。由于它們的關鍵作用,TAM已成為免疫治療的一個有希望的靶點。在Cell這篇研究論文中,研究人員開了新的協(xié)同免疫模式治療策略。
研究人員開發(fā)了:myeloid-targeted immunocytokines and natural killer (NK)/T cell enhancers (MiTEs),骨髓靶向免疫細胞因子和自然殺傷(NK)/T細胞增強劑(MiTEs),利用骨髓和淋巴細胞協(xié)同作用進行免疫治療。MiTEs是具有腫瘤特異性激活的反式免疫細胞因子,MiTEs的結構設計可以拆解為三個模塊。引導模塊:抗TREM2抗體,負責將藥物運輸?shù)絋REM2+ TAMs表面。藥物模塊:IL-2 Superkine(IL-2SK),負責激活效應T細胞和NK細胞。保險模塊:研究人員在IL-2SK的活性位點上裝上了一個遮蔽域(Masking domain,即IL-2Rβ的胞外域),這個遮蔽域通過一段特殊的肽鏈連接在抗體上。只要遮蔽域存在,IL-2就無法與其受體結合,藥物在血液循環(huán)中就是無法發(fā)揮功能的。而那段連接肽鏈,被設計為一種特定蛋白酶的底物。
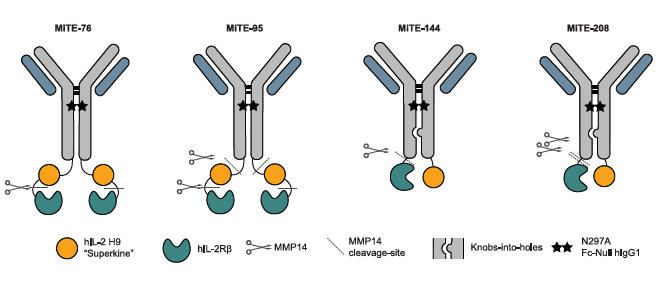
MiTEs的三部分結構組成
通過對人類癌癥圖譜和健康組織的廣泛篩選和單細胞數(shù)據(jù)顯示,MMP14((Matrix Metalloprotease 14))在腫瘤TAMs中的表達水平遠高于單核細胞或其他免疫細胞,且在健康組織中的活性極低。更重要的是,免疫熒光染色證實,MMP14與TREM2在腫瘤空間上存在共定位。MiTEs進入血液,由于IL-2被遮蔽,對全身無毒;抗TREM2抗體牽引藥物富集到腫瘤局部的TAMs表面;TAMs表面高表達的MMP14像剪刀一樣切斷連接肽;遮蔽域脫落,高活性的IL-2在腫瘤局部釋放,直接激活近在咫尺的T細胞和NK細胞。可以通過TREM2拮抗和通過白細胞介素(IL)-2激活細胞毒性效應細胞雙重靶向TAM和淋巴細胞。為了避免脫靶毒性,MiTEs含有IL-2掩膜片段,該片段被TAM特異性蛋白酶切割。MiTEs在臨床前腫瘤模型中通過跨越TAM、T和NK細胞區(qū)室的廣泛免疫重編程顯示出很高的療效。MiTEs通過誘導強效多軸抗腫瘤免疫,同時將毒性降低,顯示出治療實體癌的變革性潛力。
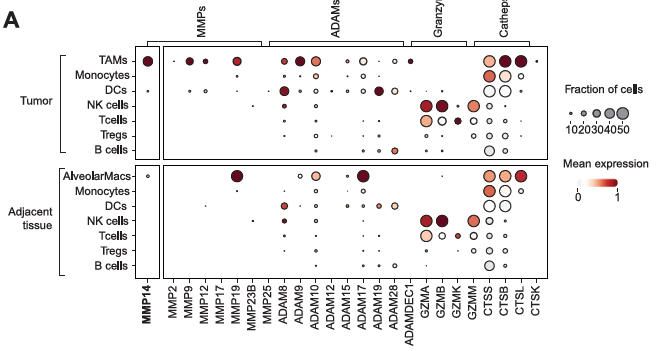
MMP14高表達在TAMs
為了探究背后的機制,研究人員對治療后第11天的小鼠腫瘤進行了單細胞測序。結果顯示,MiTE-144重塑TAMs。在治療組中,那些表達 TREM2、Mmp14 以及免疫抑制基因的TAMs群體大幅減少。取而代之的是一群高表達 S100a8、Il1b 等基因的促炎性單核細胞樣巨噬細胞(Monocyte-like macrophages)。同時,樹突狀細胞(DCs)也被激活,負責抗原交叉呈遞的基因(如 MHC class I, Irf8)表達上調。在MiTE-144治療組,尤其是聯(lián)合治療組中,CD8+ T細胞和NK細胞的數(shù)量顯著增加。T細胞表現(xiàn)出強烈的增殖(Mki67+)和細胞毒性(Gzmb+, Prf1+)。一種特殊的“干細胞樣"(Stem-like)CD8+ T細胞群體(Tcf7+)在治療后得以保留和擴增,這類細胞被認為是維持持久抗腫瘤免疫反應的源泉。與此同時,NK細胞也被深度激活。研究人員觀察到NK細胞從早期的非成熟狀態(tài)向成熟的細胞毒性狀態(tài)轉變。這提示我們,MiTEs的療效不僅僅依賴于T細胞,NK細胞的協(xié)同作用也是其強大效力的重要組成部分。
為了進一步評估MiTEs在人類腫瘤中的活性,研究人員利用腎細胞癌(RCC)患者來源的腫瘤片段(PDTFs)進行離體培養(yǎng),并對其中的CD45+ 免疫細胞進行CITE-seq(同時檢測轉錄組和表面蛋白)分析。結果顯示,MiTE-144單藥或其與抗PD-1抗體聯(lián)合治療,均能顯著促進CD8+記憶/增殖T細胞和中間態(tài)NK細胞的擴增,并激活其細胞毒性和增殖相關基因表達,而未引起Tregs或缺氧TAMs的富集。跨物種比較分析進一步證實,MiTEs在小鼠和人類腫瘤中誘導了高度保守的免疫激活程序。
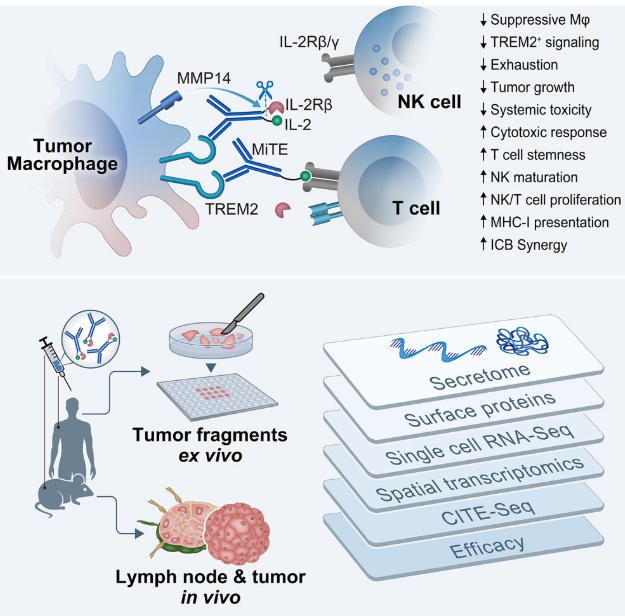
文章模式圖
該研究的核心發(fā)現(xiàn):
1.?MiTEs是用于癌癥免疫治療的新型髓系靶向免疫細胞因子前藥。
2.TREM2拮抗劑和TAM蛋白酶激活的IL-2重塑髓系-淋巴系免疫。
3.MiTEs重塑腫瘤微環(huán)境 (TME),增強體內CD8 T細胞和NK細胞的細胞毒性。
4.患者來源的腫瘤碎片驗證了MiTE活性保守性及其與αPD-1的協(xié)同作用。
荷蘭Liposoma的巨噬細胞清除劑氯膦酸二鈉脂質體Clodronate Liposomes,氯膦酸鹽脂質體,廣泛用于體內單核巨噬細胞清除。產品頻頻登刊Cell,Nature和Science,助力突破發(fā)現(xiàn)。如需訂購,可以隨時聯(lián)系。技術支持可以聯(lián)系大中華代理商靶點科技(Target Technology),專業(yè)技術團隊給您單核巨噬細胞清除提供整套解決方案。
原始文獻
von Locquenghien, Michelle et al., Macrophage-targeted mmunocytokine leverages myeloid, T, and NK cell synergy for cancer immunotherapy. Cell, Volume 188, Issue 25, 7099 - 7117.e26.